2015年至2023年我國審評上市藥品分析
Analysis of the Evaluated and Marketed Drugs in China from 2015 to 2023
黨子悅1,張鈺1,談維2,郭冬梅1△
(1.北京中醫(yī)藥大學管理學院;2.揚州大學臨床醫(yī)學院·江蘇省蘇北人民醫(yī)院) * 基金項目:國家社會科學基金“十四五”規(guī)劃教育學青年課題[CLA210281];江蘇省蘇北人民醫(yī)院管理課題[YYGL202023]。
摘 要
目的:了解我國審評上市藥品的整體情況。方法:檢索2015年至2023年國家藥品監(jiān)督管理局藥品審評中心(CDE)公開的審評上市藥品的相關信息,從藥品數(shù)量、創(chuàng)新程度、治療領域3個方面分析我國上市藥品的發(fā)展趨勢,從政策和產(chǎn)業(yè)角度為我國未來的藥品研發(fā)創(chuàng)新提出合理建議。結果:從藥品數(shù)量分析,2015年至2023年我國審評上市藥品共1138件,包括1類新藥168件、改良型新藥315件、其他類型新藥655件,平均增幅約為28.22%,中藥(24件)的新藥數(shù)量較化學藥品(680件)和生物制品(434件)少。從創(chuàng)新程度分析,化學藥品在1類、改良型、其他類型新藥的占比分別為60.71%,39.05%,69.47%,生物制品分別為30.95%,58.73%,30.08%,中藥分別為8.33%,2.22%,0.46%;中藥、化學藥品、生物制品1類新藥在自身藥品中的占比分別為58.33%,15.00%,11.98%。從治療領域分析,抗腫瘤藥物數(shù)量最多(391件,占34.36%),同質(zhì)化競爭明顯。結論:建議國家藥品監(jiān)督管理部門加大對中藥品種審評的關注力度,不斷提升中藥新藥、原創(chuàng)新藥的研發(fā)能力;藥品生產(chǎn)企業(yè)應注重原創(chuàng)基礎研究,提升供給能力和新藥開發(fā)能力。
關鍵詞:審評上市藥品;藥品創(chuàng)新;新藥研發(fā);醫(yī)藥產(chǎn)業(yè)
Key words:evaluated and marketed drug;pharmaceutical innovation;new drug research and development;pharmaceutical industry
中圖分類號:R95 文獻標志碼:A
藥品審評上市在改善病種發(fā)病率和死亡率的同時也意味著藥品商業(yè)化的開始。我國的藥品審評上市滯后問題已存在多年,國家藥品監(jiān)督管理局藥品審評中心(CDE)的注冊申請積壓一度影響了藥品的可及性。2015年起,我國開始新一輪藥品審評制度改革。《關于改革藥品醫(yī)療器械審評審批制度的意見》(國發(fā)〔2013〕44號)提出,鼓勵研究和創(chuàng)制新藥;《關于發(fā)布化學藥品注冊分類改革工作方案的公告》(2016年第51號)重新定義新藥,只有境內(nèi)外均未上市的創(chuàng)新藥才是新藥;《關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》為創(chuàng)新藥的審評審批提供了最大的便利;《藥品管理法(2019年修訂)》明確指出,支持臨床價值為導向的創(chuàng)新;《藥品注冊管理辦法》(國家市場監(jiān)督管理總局令第27號)進一步強調(diào)了臨床價值的創(chuàng)新。在一系列政策引導下,我國藥品審評上市的進程不斷加快,醫(yī)藥企業(yè)創(chuàng)新積極性提高,不斷加大藥品創(chuàng)新投入,創(chuàng)新成果不斷涌現(xiàn)。本研究中從藥品數(shù)量、創(chuàng)新程度、治療領域3個方面分析了2015年至2023年CDE承辦審評并上市的藥品情況,并提出針對性建議。
1 資料來源與方法
1.1 資料來源
選取CDE公開上市藥品信息欄的數(shù)據(jù),收集并整理2015年至2023年CDE承辦審評已上市藥品的信息,數(shù)據(jù)檢索時限截至2024年2月22日。按受理號計共審評上市藥品1138件,下載技術審評報告,提取受理件數(shù)、藥品名稱(非最終上市藥品通用名稱)、上市持有人信息、藥品類型、注冊分類、是否加快上市、適應證等條目的信息。
1.2 方法 根據(jù)中藥、化學藥品、生物制品的藥品類型分類,總結藥品數(shù)量;根據(jù)國家藥品監(jiān)督管理局(NMPA)明確的新藥是“未在中國境內(nèi)外上市銷售的藥品”,以及2020年頒布的中藥、化學藥品、生物制品注冊分類標準,總結藥品創(chuàng)新情況;根據(jù)《國務院關于實施健康中國行動的意見》(國發(fā)〔2019〕13號)中明確的“心腦血管疾病、癌癥、慢性呼吸系統(tǒng)疾病、糖尿病等慢性非傳染性疾病導致的死亡人數(shù)占總死亡人數(shù)的88%”,以及《國際疾病診斷與編碼(第10版)》(ICD-10)醫(yī)保版疾病分類標準確定藥物治療領域,總結治療領域情況。
2 結果
2.1 藥品數(shù)量
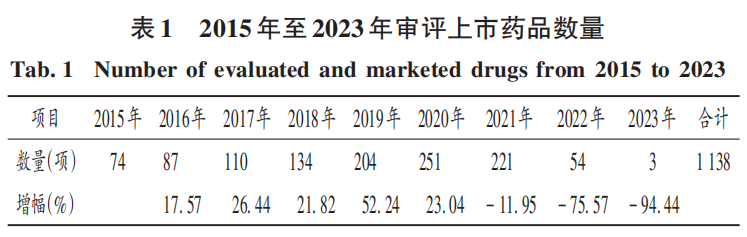
2015年至2020年,我國審評上市藥品數(shù)量逐年增加,平均增幅約為28.22%。這是由于《關于改革藥品醫(yī)療器械審評審批制度的意見》(國發(fā)〔2015〕44號)明確了責任落實及嚴格的懲罰制度,加快藥品審評審批,解決申請積壓的現(xiàn)實問題,保證藥品盡快上市,滿足患者的用藥需求。2021年起,審評上市藥品數(shù)量逐年減少。詳見表1。
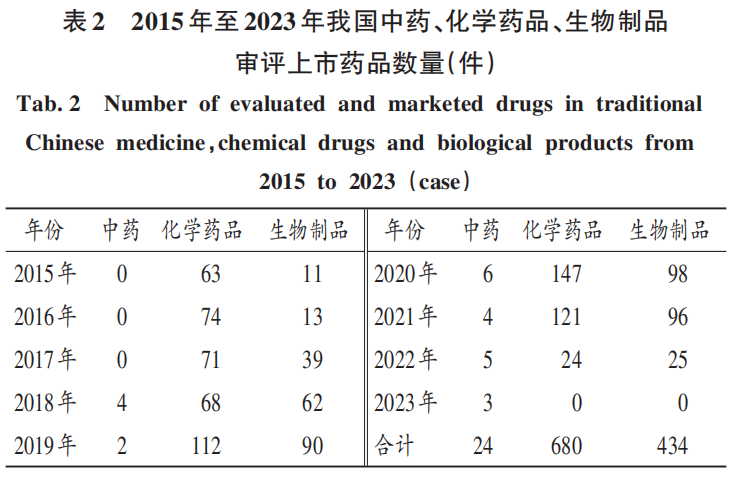
中藥為我國的醫(yī)藥特色和優(yōu)勢領域,化學藥品為醫(yī)藥產(chǎn)業(yè)研發(fā)生產(chǎn)的中堅力量,生物制品的研發(fā)與產(chǎn)業(yè)化能力大幅提高。2015年至2023年,審評上市化學藥品最多(680件),其次為生物制品(434件),中藥的數(shù)量最少(24件)且變化幅度小。其中,2015年至2017年上市中藥數(shù)量均為0件,2018年至2023年上市中藥共24件,表明藥品生產(chǎn)企業(yè)對中藥領域的研發(fā)生產(chǎn)熱度不夠。詳見表2。
2.2 藥品創(chuàng)新情況
2.2.1 藥品注冊分類體系
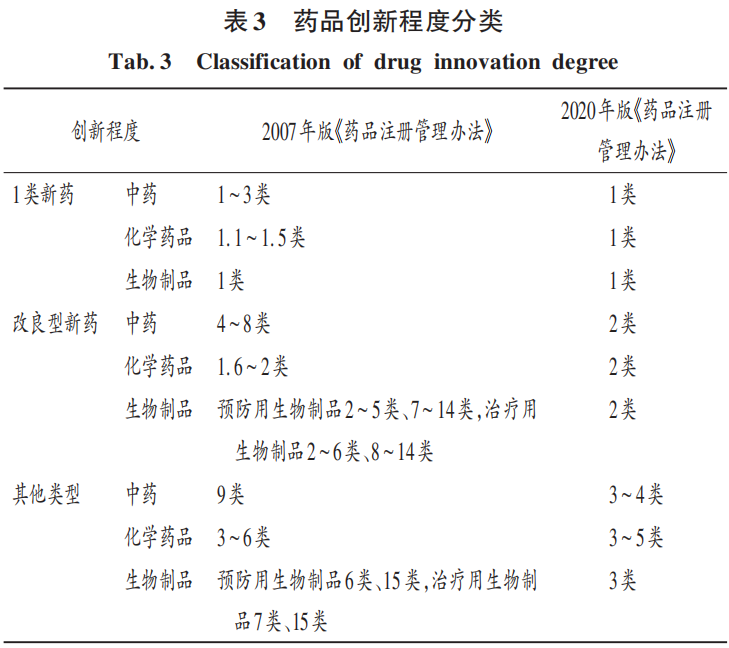
根據(jù)藥品注冊分類辦法,化學藥品、生物制品建立了創(chuàng)新、改良和仿制的基本分類體系,中藥按創(chuàng)新藥、改良型新藥、古代經(jīng)典名方中藥復方制劑、同名同方藥等進行分類。表明我國開始與發(fā)達國家的注冊分類方法接軌,既考慮了加快臨床為導向的創(chuàng)新需求,也考慮了以仿制為生存模式企業(yè)的需求,同時也注重中藥的傳承與發(fā)展,形成了符合中藥特點的注冊分類體系。本研究中根據(jù)CDE發(fā)布的技術審評報告中的注冊分類信息,考慮前后政策的銜接性,按1類新藥、改良型新藥、其他類型分類,區(qū)分藥品的創(chuàng)新程度。詳見表3。
2.2.2不同類型藥品創(chuàng)新程度
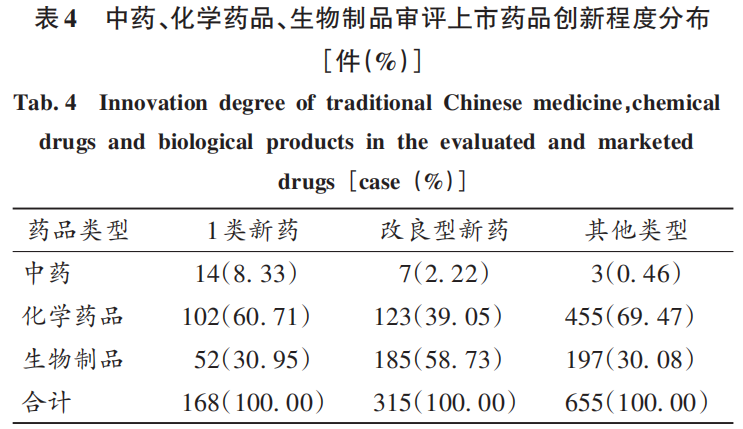
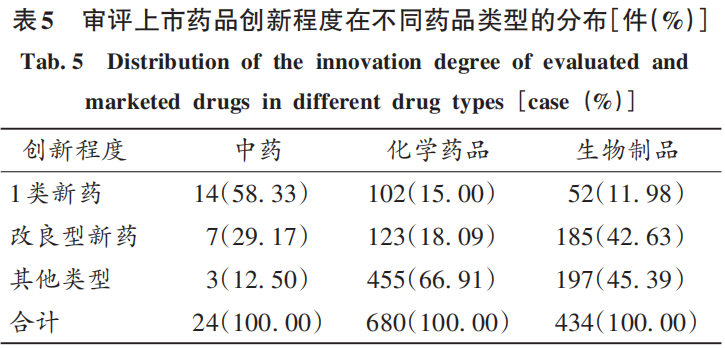
從不同類型藥品的創(chuàng)新程度看,化學藥品在1類新藥、其他類型的占比均最高(>60%),表明當前我國醫(yī)藥產(chǎn)業(yè)格局仍以化學藥品為主;生物制品的占比次之(>30%),表明我國生物醫(yī)藥領域發(fā)展勢頭迅猛,產(chǎn)業(yè)布局不斷加強。生物制品改良型新藥占比最高(58.73%),這與我國生物醫(yī)藥產(chǎn)業(yè)起步較晚,早期注冊分類政策對生物制品創(chuàng)新程度的區(qū)分不明顯有關;另外,改良型新藥是在原有藥物基礎上進行改進,具有更好的臨床療效,與新化學實體和創(chuàng)新生物藥相比,改良型新藥的研發(fā)時間縮短約67%,研發(fā)成本降低約99%,研發(fā)成功率提高約23%。生物制品占比高,也從側面反映出藥品生產(chǎn)企業(yè)對該領域研發(fā)熱度及研發(fā)能力的提升。詳見表4。
從1類新藥的創(chuàng)新程度來看,中藥1類新藥在中藥中的占比最高(58.33%),盡管中藥品種總體數(shù)量少,其占比在一定程度上不能完全反映中藥領域的創(chuàng)新水平,但其中13件1類新藥中藥是2020年至2022年CDE開始承辦審評并完成上市的,表明從2017年起中藥領域立法到研發(fā)、審評、上市各環(huán)節(jié)的政策引導和扶持效果開始顯現(xiàn);生物制品1類新藥的數(shù)量較化學藥品少,但兩者占比相當(11.98%比15.00%),這與生物制品治療某些疾病具有明顯臨床優(yōu)勢相關,如靶向治療和免疫治療為腫瘤的常用治療手段,同時與藥品生產(chǎn)企業(yè)不斷加大研發(fā)力度有關。詳見表5。
2.2.3 境內(nèi)外不同類型審評上市藥品數(shù)量
境內(nèi)審評上市藥品共400件,其中1類新藥、改良型新藥、其他類型新藥分別有147件、187件、66件;境外審評上市藥品共738件,其中1類新藥、改良型新藥、其他類型新藥分別有21件、128件、589件。可見,境內(nèi)1類新藥數(shù)量多且占比高,這是由于我國明確新藥為“未在中國境內(nèi)外上市銷售的藥品”,原研藥在我國上市注冊并不滿足新藥條件導致;另外,境內(nèi)1類新藥數(shù)量為境外的7倍,較改良型新藥倍數(shù)差(1.46倍)明顯,表明明確藥品注冊分類相關政策對本土藥品研制創(chuàng)新有保護和激勵作用。
2.3 藥品治療領域分布情況 2.3.1境內(nèi)外原創(chuàng)新藥研發(fā)能力 境內(nèi)外抗腫瘤藥物均最多,但同質(zhì)化競爭嚴重,上市產(chǎn)品差異不明顯,詳見表6。與美國2022年批準的21款“first-in-class”藥品數(shù)量相比,我國原創(chuàng)新藥的研發(fā)能力較弱。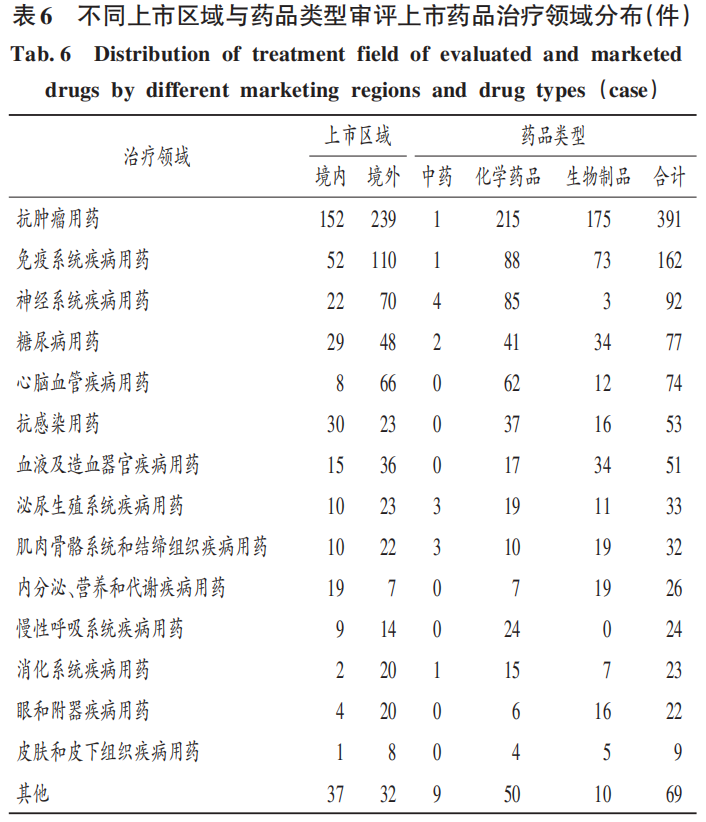
2.3.2與當前疾病譜變化相關
從審評上市數(shù)量看,治療領域排名前5的依次為抗腫瘤用藥、免疫系統(tǒng)疾病用藥、神經(jīng)系統(tǒng)疾病用藥、糖尿病用藥和心腦血管疾病用藥,這與我國當前疾病譜的變化密切相關;從藥品類型上看,中藥側重情緒、身體機能調(diào)節(jié),化學藥品和生物制品的治療領域與當前疾病譜的發(fā)展變化聯(lián)系更密切。詳見表6。
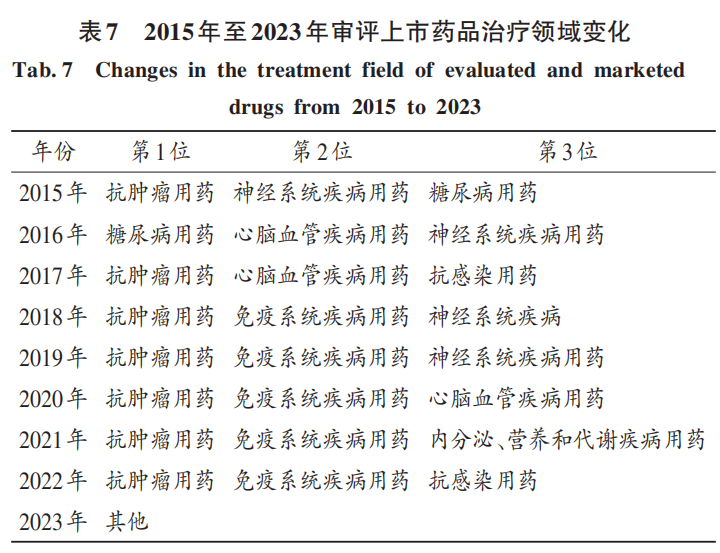
從時間序列上看,受生活水平提高、工作壓力加大、人口老齡化等因素的影響,腫瘤、高血壓、高血糖、血脂代謝異常、神經(jīng)系統(tǒng)、慢性腎臟病等疾病領域的用藥成為藥品研發(fā)創(chuàng)新增長點,腫瘤、免疫抗感染等治療領域已成為上市藥品研發(fā)的熱點領域。詳見表7。由于藥品審評上市需要一定時間,距離本研究時間較近,故表7中的2023年審評上市藥品治療領域變化情況不能反映真實情況,需結合后續(xù)藥品監(jiān)督管理部門公布的數(shù)據(jù)進行分析。
2.3.3境內(nèi)外罕見病用藥和兒童用藥審評上市數(shù)量
2015年至2020年,罕見病用藥和兒童用藥審評上市數(shù)量整體呈上升趨勢。詳見表8。罕見病用藥中,境內(nèi)上市13件,境外上市97件;兒童用藥中,境內(nèi)上市36件,境外上市58件。表明境外制藥企業(yè)對這類藥物的研發(fā)熱情和能力優(yōu)于境內(nèi)企業(yè),由于罕見病患者數(shù)量有限,以及對其病因、病理生理學及流行病學認識的欠缺,隨著對藥物的深入了解,罕見病和兒童用藥的市場潛力不斷增加,注重研發(fā)的趨勢正在全球范圍穩(wěn)步增長,境外制藥企業(yè)正在不斷加快對這類藥品市場的商業(yè)布局。

3 討論
3.1 中藥領域
藥品開發(fā)關注度不夠,研發(fā)能力相對較弱:中藥上市數(shù)量及其1類新藥的占比均低于化學藥品和生物制品,表明中藥從研發(fā)到上市過程中,臨床試驗申請、上市注冊申請的基數(shù)小。早期中藥審批標準偏低,中藥仿制藥只要符合國家標準即可減免相關研究,導致藥品生產(chǎn)企業(yè)研制新藥的積極性不強,申報簡單改劑型和仿制中藥的數(shù)量急劇增多,早期政策并未充分引導中藥品種的開發(fā)與創(chuàng)新。2017年,我國加入人用藥品注冊技術要求國際協(xié)調(diào)會(ICH),意味著我國新藥研發(fā)標準正式與國際接軌。一方面,國家對新藥研發(fā)的技術要求越來越高,使獲批門檻越來越高;另一方面,藥品生產(chǎn)企業(yè)對中藥新藥研發(fā)相關技術要求不夠了解,存在盲目、低水平重復申報等情況。藥品審評標準的提升,與藥品生產(chǎn)企業(yè)的創(chuàng)新能力短時間內(nèi)并未得到充分發(fā)展形成矛盾點,使中藥研發(fā)創(chuàng)制的積極性降低,市場主體轉移對中藥領域的關注度,最終導致中藥新藥的研制較其他藥品領域處于弱勢地位,中藥產(chǎn)業(yè)成果的審評和上市效果不佳。
加快中藥新藥研發(fā)的工作實際指導,提升中藥新藥研制能力:1)理清中藥研發(fā)的思路。與化學藥品自實驗室化合物合成后再通過現(xiàn)代藥理毒理學評價和臨床試驗驗證其有效性的研發(fā)思路不同,中藥新藥研發(fā)一般源于臨床有效方劑、民間驗方、醫(yī)院制劑、已有中成藥加減、經(jīng)典名方、現(xiàn)代藥效篩選結果。建議中藥創(chuàng)新的政策要不斷完善技術指導原則,審評審批政策也要依據(jù)中藥研發(fā)思路以臨床價值為導向加快中藥新藥審批上市程序。2)加大中藥產(chǎn)業(yè)創(chuàng)新投入。提高中藥領域原輔料和工藝控制水平及質(zhì)量終端檢測手段,重視中藥藥效物質(zhì)基礎研究,為解決制約中藥發(fā)展的成分復雜和作用機制不明確的難題提供依據(jù)。可從心血管、感冒、消化代謝和婦兒中藥優(yōu)勢領域藥品的研發(fā)入手,不斷積累中藥研發(fā)的經(jīng)驗,總結研發(fā)過程中的問題,形成制度化發(fā)展模式并加以推廣。
3.2 我國原創(chuàng)新藥研發(fā)能力 藥物治療領域集中,原創(chuàng)新藥開發(fā)能力仍需提高:隨著我國政策紅利的持續(xù)加碼,全球資本的商業(yè)布局及產(chǎn)業(yè)技術的迭代升級,我國藥品創(chuàng)新能力顯著提高,但仍以跟隨創(chuàng)新為主,在原創(chuàng)新藥領域處于劣勢狀態(tài)。從疾病治療領域看,近年來罕見病正成為生物制藥行業(yè)的熱點,但我國境內(nèi)審評上市的藥品數(shù)量少,藥品研發(fā)扎堆現(xiàn)象較突出。如程序性死亡受體1(PD-1)單抗是腫瘤治療領域最集中的研究靶點,重點產(chǎn)品適應證布局越來越重疊,導致缺少真正的“first-in-class”產(chǎn)品,不利于原創(chuàng)新藥的產(chǎn)出。從藥品研發(fā)階段看,我國藥品研發(fā)公司通過承接外包服務方式,更多承擔了國際藥企藥品研發(fā)前端的研究工作,同時我國在基礎研究領域較國際第一梯隊國家的能力弱,使我國原創(chuàng)新藥的上市研發(fā)能力不能得到充分發(fā)展。 加大藥物創(chuàng)新政策扶持和產(chǎn)業(yè)布局,提升原創(chuàng)新藥研制能力:隨著創(chuàng)新藥品研發(fā)難度的增加,全球藥物研發(fā)逐步從“重磅炸彈式藥品開發(fā)模式”向“個體化精準用藥模式”轉型。大數(shù)據(jù)與人工智能、基因編輯、細胞療法等新興技術和療法在制藥領域的深度交叉融合,將會顛覆針對所有患者群體的藥物研發(fā),可能會通過虛擬和分散式臨床試驗的模式達到個體化精準用藥。建議國家藥品監(jiān)督管理部門盡快完善上述相關領域技術的指導原則,促進產(chǎn)-學-研深度合作,加強基礎研究,研制創(chuàng)新所需大型設備,加速醫(yī)藥研發(fā)新技術的迭代升級,實現(xiàn)醫(yī)藥產(chǎn)業(yè)鏈供給側的升級,有效避免同質(zhì)化藥品的“高水平重復”,逐步提升我國原創(chuàng)新藥領域的研發(fā)能力。罕見病用藥作為保障用藥可及性的重要領域,建議我國藥品生產(chǎn)企業(yè)加快對罕見病領域的開發(fā)和商業(yè)布局,國家藥品監(jiān)督管理部門不斷完善支持罕見病研發(fā)的技術指導原則,加快上市政策傾斜,以改善治療領域集中現(xiàn)象。 3.3 小結與建議 自2015年我國實施藥品審評審批制度改革,全面推進仿制藥一致性評價,確定以臨床價值為導向的創(chuàng)新政策以來,藥品研發(fā)創(chuàng)制政策環(huán)境得到改善和優(yōu)化,藥品研發(fā)市場紅利進一步得到釋放,我國逐步“從仿制為主”向“創(chuàng)新模式”轉變。在政策引導和激勵下,藥品生產(chǎn)企業(yè)的創(chuàng)新積極性得到提高,創(chuàng)新成果不斷涌現(xiàn),參與全球藥品研發(fā)合作與競爭的能力不斷提高。 藥品生產(chǎn)企業(yè)作為創(chuàng)新藥研發(fā)的重要主體,要對新藥研發(fā)具有“投入多、周期長、風險大”的認知,在商業(yè)布局過程中應避免研發(fā)投入金額過高,研發(fā)投入項目過于分散,導致研發(fā)收益不足、成長受損等問題的發(fā)生;研發(fā)創(chuàng)新生物藥時要關注到患者對延長生命及對生活質(zhì)量提高的期望,創(chuàng)新藥品應圍繞疾病的臨床需求。建議國家藥品監(jiān)督管理部門總結上市審評的問題,不斷細化研發(fā)過程的技術指導原則,加強與市場主體參與者的溝通交流,明確各項政策原則和導向,不斷加快藥品審評政策與國際政策的銜接,為境內(nèi)新藥能順利在境外上市做好政策支持,提升我國藥物創(chuàng)新技術標準,刺激我國原創(chuàng)新藥的不斷上市。
*參考文獻:略(掃描二維碼可下載查看)。
作者簡介: 第一作者:黨子悅,女,碩士研究生在讀,研究方向為藥事管理學。 △ 通信作者:郭冬梅,女,博士研究生,副教授,研究方向為藥事管理學與醫(yī)藥產(chǎn)業(yè)經(jīng)濟。 該文完整發(fā)布于《中國藥業(yè)》雜志2024年12月5日出版的第33卷第23期第6~10頁。 掃描下方二維碼即可查看和下載本文高清PDF版↓↓↓